聚焦药靶:新药发展第三次浪潮——小核酸药物的最新研究进展
文章来源:微信公众号
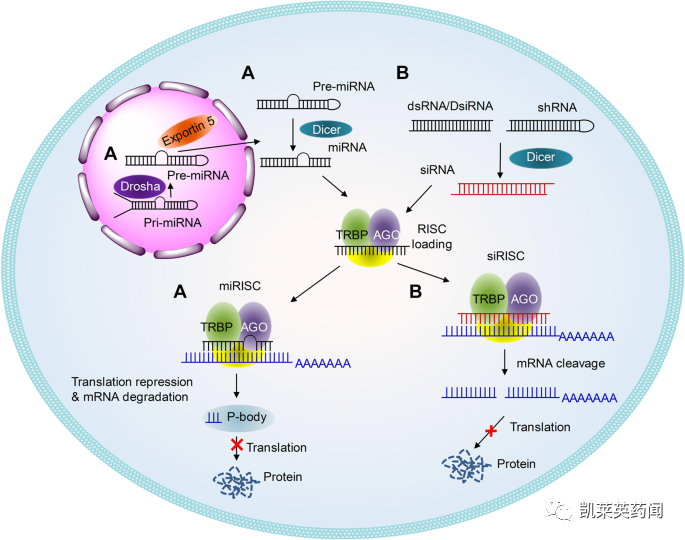
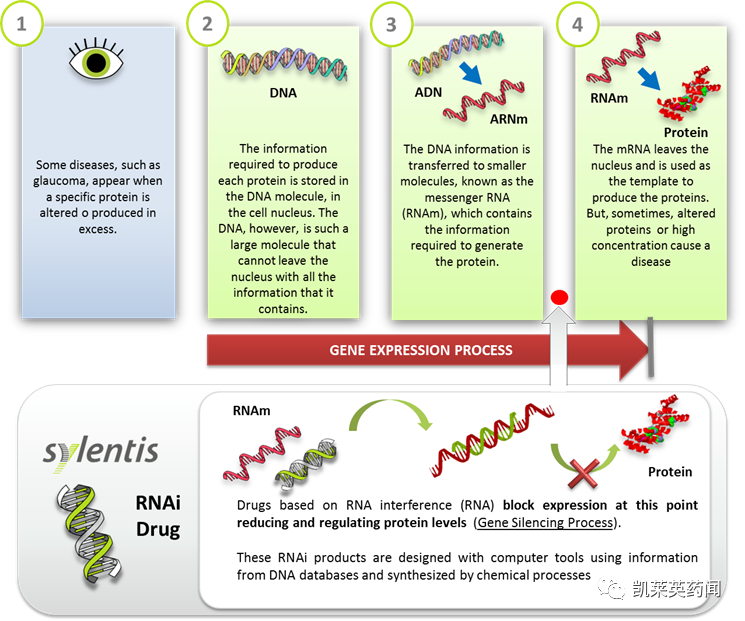
小核酸药物是指能利用siRNA 、miRNA及反义核酸(ASO)等核酸小分子特异性地沉默疾病基因的表达,以治愈特定疾病的药物。小核酸药物主要分为siRNA 、miRNA 、ASO、小激活RNA(saRNA)、核酸适配体(aptamer)、转运RNA(tRNA)碎片、抗体核酸偶联药物(ARC)等。其中siRNA 是指双链RNA或发卡结构RNA 经核酸内切酶剪切后形成,在解旋酶作用下生成正义链和反义链,并形成RNA 诱导沉默复合体RISC,RISC将靶基因的mRNA 切割降解, 从而抑制靶基因的表达;siRNA药物主要通过RNAi 机制对靶基因进行调控。miRNA 是指前体miRNA 被转运到细胞质中, 核酸内切酶将其剪切成约为20-24 bp 的miRNA 双链。随后被载入RISC 中,一条单链miRNA 被降解,另一条成熟的单链miRNA 分子与靶mRNA 序列互补配对,调节基因的表达。ASO是指其mRNA 或其它RNA 互补的DNA 或RNA 分子,可以与mRNA 或者Pre-mRNA特异性的互补结合,抑制该mRNA 的翻译或引起mRNA 的降解,调节蛋白的表达及细胞的生长、分化等,从而起到治疗疾病的作用。Aptamer 是人工合成的短单链DNA或者RNA序列,其通过自身的三维构型与其标靶,如蛋白质、细胞、病毒等实现特异性结合。
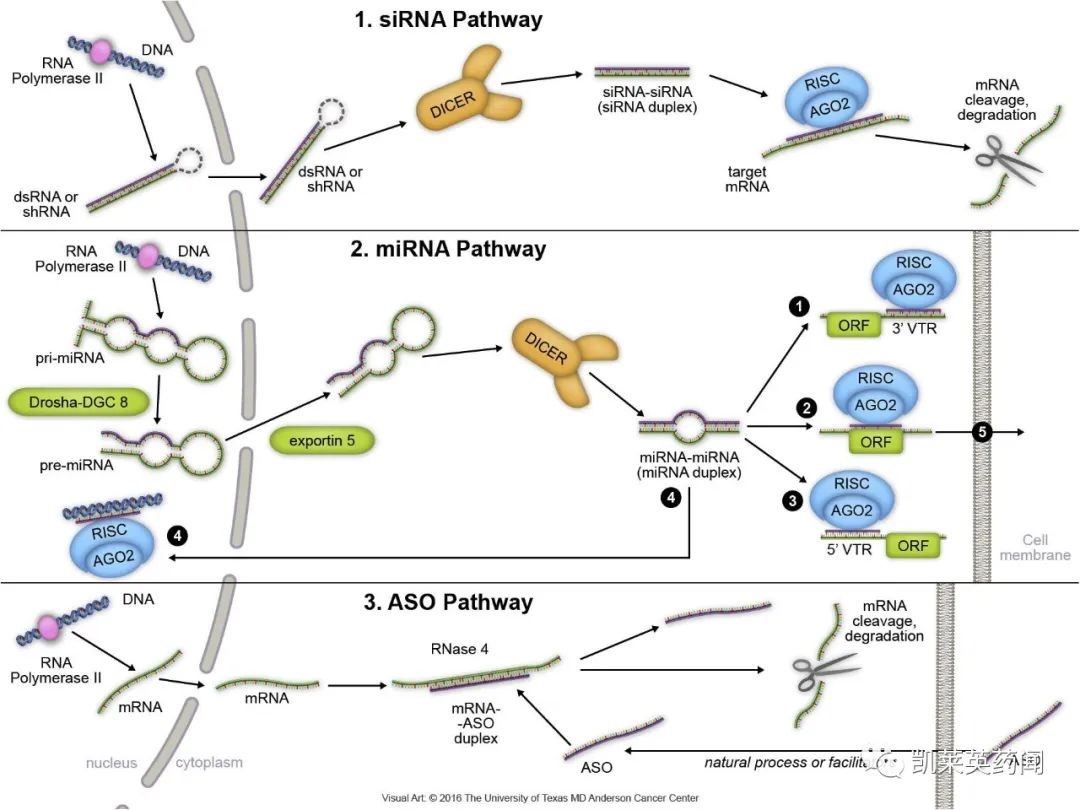
小核酸药物的优势是特异性靶向多个基因从而治疗疾病,可干涉细胞的增殖、血管生成、转移、化疗抗性等,这些优势使得小核酸药物被开发用于包括肿瘤、多种罕见病如肌萎缩性脊髓侧索硬化、杜氏肌营养不良、脊髓性肌萎缩、病毒性疾病、肾脏疾病、心血管疾病等。相比抗体药,核酸药物研发阶段不需要进行复杂蛋白修饰和CMC开发(工艺和质量控制),生产阶段制备工艺相对简单,不需要大规模哺乳动物细胞发酵和蛋白纯化,具有候选靶点丰富、研发周期短、药效持久、临床开发成功率高等优势。小核酸药物从转录后水平进行治疗,能针对难以成药的特殊蛋白靶点实现突破,有望攻克尚无药物治疗的疾病包括遗传疾病和其他难治疾病;具备针对“不可靶向”、“不可成药”疾病开发出治疗药物的巨大潜力,有望形成继小分子药物、抗体药物之后的现代新药第三次浪潮。
由于小核酸药物是基于RNA 结构进行设计的,人体内有很多水解RNA的酶,因此在人的循环系统中,小核酸药物非常容易被水解掉,稳定性不足;另外一方面,小核酸药物虽然能够精确的通过碱基互补配对识别靶序列,但是由于小核酸药物是带有负电荷的核酸大分子,很难通过细胞膜进入细胞内部发生作用,并且也不具有对特定组织或者细胞的靶向能力,因此小核酸药物的给药方式和载体,对于小核酸药物的成败具有决定性影响;同时,小核酸药物的毒副作用也不容小觑,比如正义链与同源基因进行配对使得同源基因表达沉默,引发正义链介导的脱靶效应,或者小核酸药物引发体内免疫反应等。现今可以针对小核酸药物的缺陷,研发出很多改良技术。
一
最新研究进展
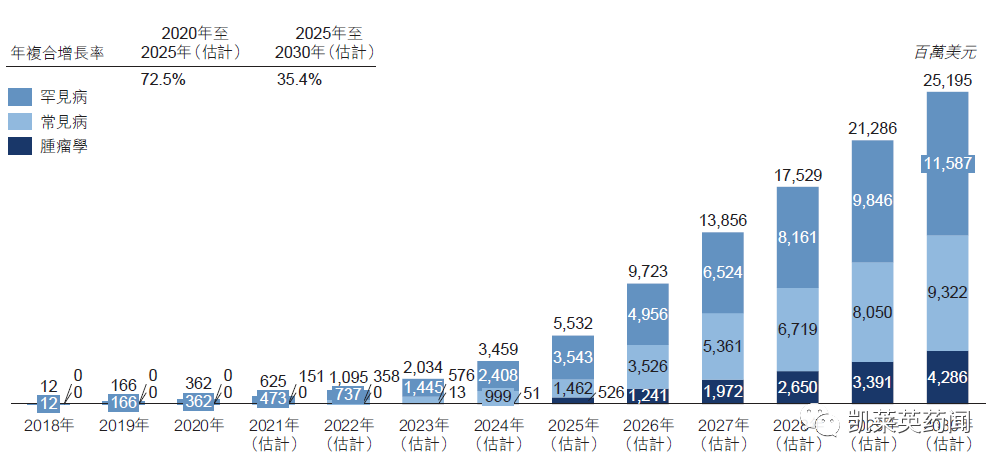
1、据不完全统计,全球目前在研的小核酸药物近500种,其中获批上市14种药物,2021年销量超过25亿美元。
2、根据灼识咨询数据,预计到2025 年全球小核酸药物销售额将突破100 亿美元,其中RNAi 疗法凭借其较为显著的效果有望能够实现快速增长,到2025 年预计将达到55 亿美元,复合增速达到73%。
全球RNAi 药物的市场规模
3、在研究企业上,按药物数量依次是Ionis Pharmaceuticals(92)、Alnylam Pharmaceuticals(34)、Arrowhead Pharmaceuticals(25)、Sarepta Therapeutics(19)、Sirnaomics(17)、ProQR Therapeutics(16)、Roche(12)、Dicerna Pharmaceuticals(11)、AstraZeneca(11)、Biogen(10);此外,国内企业瑞博生物、先导生物、齐鲁、天龙医药、海昶生物、吉玛基因、腾盛博药、彭济凯丰均在该领域进行布局。
4、在适应症上,以肿瘤的研究数量最多,还包括眼科疾病、代谢疾病、高脂血症、乙型肝炎、假肥大性肌营养不良、非酒精性脂肪性肝病、心脏病、肌萎缩侧索硬化症、囊性纤维化等。
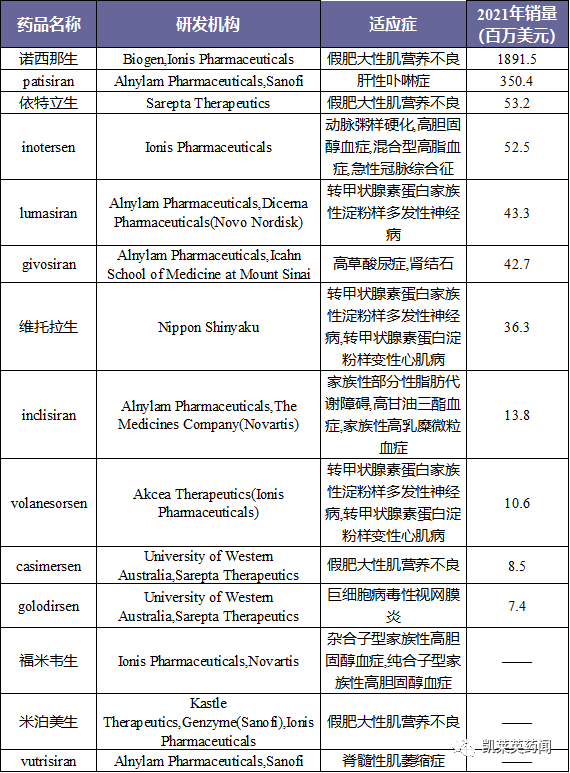
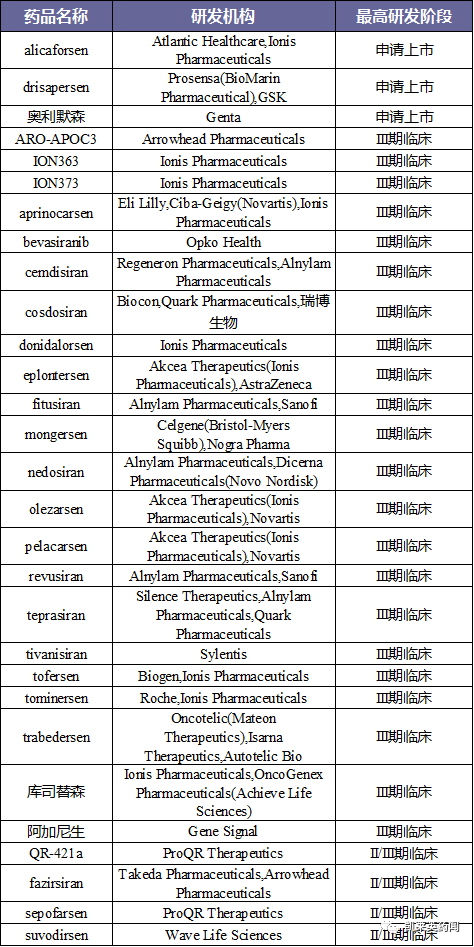
5、将目前处于II/III期临床以上阶段的药物统计如下:
二
重点药物介绍
1、Biogen&Ionis:诺西那生
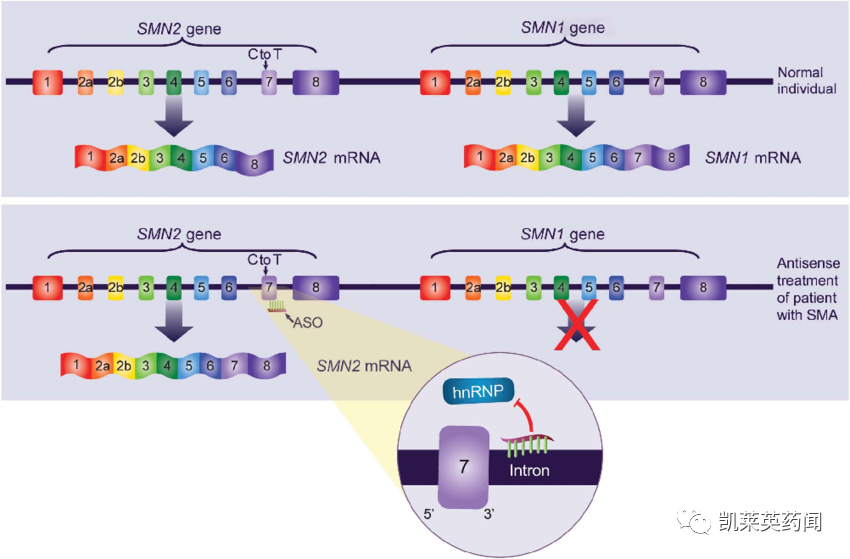
诺西那生(nusinersen)是由Biogen和 Ionis 制药联合开发的一种ASO,目前已在全世界包括中国的40多个国家地区获批上市,用于治疗儿童和成人的脊髓性肌萎缩症(SMA)。诺西那生通过改变SMN2基因的剪接,增加全功能性SMN蛋白的生产,通过鞘内注射给药,可以直接将药物输送到脊髓周围的脑脊液中,从而改善运动功能、提高生存率,改变SMA的疾病进程。在临床试验项目中,诺西那生钠显示出了良好的获益风险比,最常见的不良反应是呼吸道感染和便秘。ASO给药后出现凝血异常和血小板减少,包括急性重度血小板减少。患者可能增加出血并发症的风险。SMA是一种罕见的遗传性神经肌肉疾病,以脊髓和下脑干中运动神经元的丢失为特征,从而导致严重的、进行性肌肉萎缩和无力;如果不进行治疗,大多数患有较严重疾病类型(SMA I型)的婴儿在没有呼吸干预的情况下,无法活到两岁。
2、Alnylam&Sanofi:Patisiran
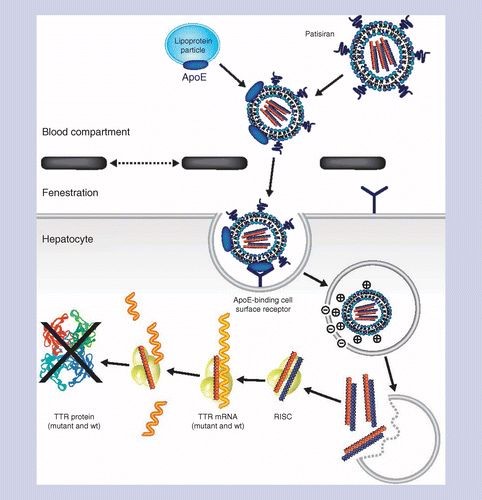
Patisiran(Onpattro )是全球第一款RNAi药物,由Alnylam和Sanofi联合开发,用于治疗遗传性甲状腺素介导的淀粉样变性的多发性神经病(hATTR)。Onpattro将siRNA包裹在脂质纳米颗粒中,在输注治疗中将药物直接递送至肝脏,通过与编码异常甲状腺素蛋白(TTR)的mRNA相结合,阻止TTR的产生。根据2021年发表于Neurology上的文章,使用Olink Explore蛋白组平台,对使用patisiran的受试者进行检测,通过对上千种生物标志物的系统分析,最终发现一个新型的蛋白标志物Nlf可用于监控hATTR疾病进展和药物治疗响应;同时,Olink PEA技术发现的心脏健康相关的生物标志物NT-ProBNP与APOLLO临床试验中阳性标志物一致。hATTR是由基因突变引起的,这种突变会影响体内TTR的功能。TTR蛋白主要在肝脏中产生,是维生素A的载体。当TTR发生突变时,人体内会积累异常的淀粉样TTR(ATTR),对人体器官和组织(如周围神经和心脏等)造成损伤,引发难以治疗的外周感觉神经病变、自主神经病变或心肌病。
3、Sarepta Therapeutics:依特立生
依特立生(eteplirsen 、Exondys51)是由Sarepta Therapeutics 开发的ASO药物,是FDA目前唯一批准的治疗杜氏肌营养不良(DMD)药物。Exondys 51靶向抗肌萎缩蛋白mRNA前体的剪接过程,旨在引入外显子51跳跃(exon 51 skipping),生成截短但仍具有功能的抗肌萎缩蛋白。Exondys 51的获批是基于其在临床试验中达到了多项生物学终点,包括正确完成外显子跳跃的RNA生成水平,抗肌萎缩蛋白的表达,及肌肉强度的增加。据统计,约有13%的DMD患者携带的基因突变适合外显子51跳跃疗法。
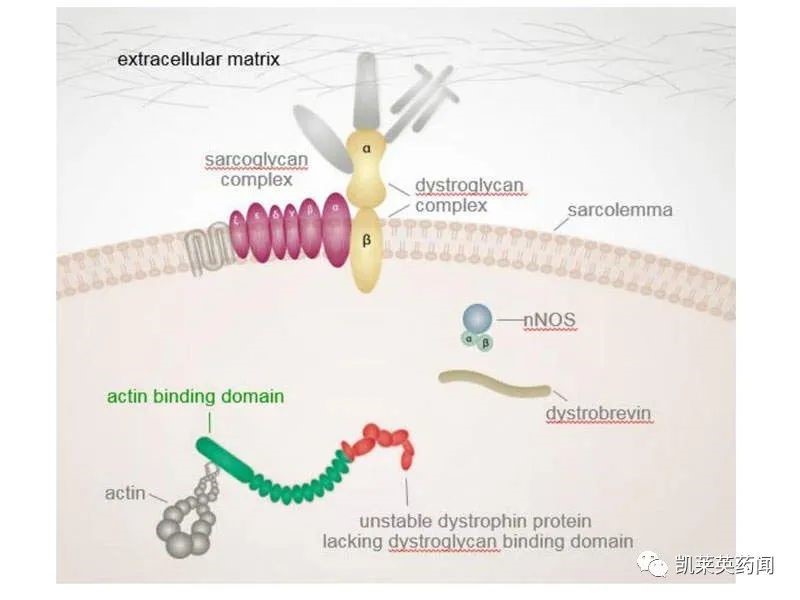
4、Nippon Shinyaku:维托拉生
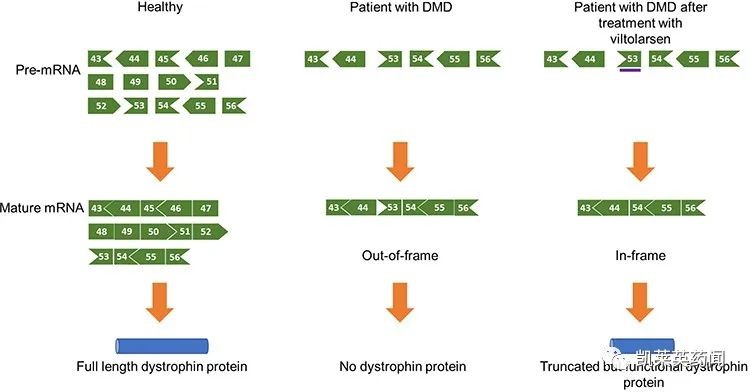
维托拉生(viltolarsen)是日本新药株式会社开发的一种ASO药物,于2020 年 3 月在日本获批上市,用于治疗DMD。维托拉生通过跳过外显子 53,使部分患者 DMD 基因的移框缺失变为同框缺失,以减轻症状(尽量接近 BMD的外在表现)。2021年8月,CDE 宣布将维托拉生纳入优先审评审批,用于肌营养蛋白的基因缺失经验明可通过 53 号外显子跳跃治疗的杜氏肌营养不良。目前,公司针对 4-8 岁、具有独立行走能力的DMD男童,正在开展一项为期 48 周的随机、双盲、安慰剂对照、国际多中心临床试验,旨在探究维托拉生在研究群体中的疗效、安全性和耐受性。
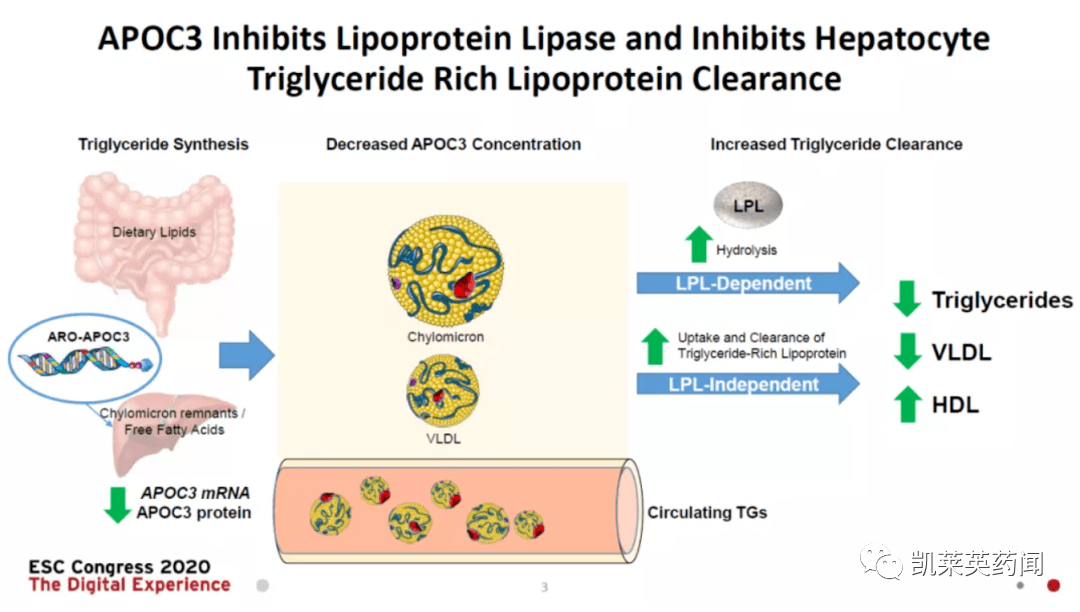
5、Arrowhead:ARO-APOC3
ARO-APOC3是由Arrowhead一款靶向APOC3 mRNA的RNAi疗法,通过沉默APOC3的表达,来降低有害脂蛋白指标(即TG和VLDL水平),提升“好”胆固醇HDL的水平。ARO-APOC3正在被开发用于治疗高甘油三酯血症(HTG)、严重高甘油三酯血症 (sHTG) 和家族性乳糜微粒血症综合征 (FCS) 。在2021年11月公布的数据显示,4例FCS患者在接受ARO-APOC3治疗后,APOC3平均降低98%,甘油三酯(TG)平均减少91%,并且耐受性总体良好。此外,25例高甘油三酯血症的非FCS患者在ARO-APOC3治疗后,疗效和安全性结果与4例FCS患者类似。
6、Sylentis:Tivanisiran
Tivanisiran是Sylentis公司开发的一种瞬时电位通道香草醛亚型-1 (TRPV1)的siRNA基因疗法,角膜受三叉神经的传入纤维支配,其中TRPVI1蛋白在这一过程中充当疼痛传感器,其受体与应激产生的炎症和纤维增生有关。目前处于III期试验,是开发得最快的针对神经性疼痛干眼症的siRNA疗法。
-
2022-09-15
39个国家级核酸药物技术攻关项目立项,不
国家生物药技术创新中心发布2022年国家生物药技术创新中心核
-
2022-08-17
本周创新药NDA和IND汇总
文章来源:凯莱英药闻「收集周期:8月8日-8月13日,包括“
-
2022-08-04
2022年7月国内生物医药投融资汇总
文章来源:凯莱英药闻2022年7月,我国有25家创新药企完成
-
2022-07-22
双抗市场即将爆发?武田与F-star 就
文章来源:凯莱英药闻2022年7月20日,F-star Th…
-
2022-07-14
【药政】2022年6月医药行业政策
文章来源:微信公众号6月,NMPA发布《2021年度药品审评
